Pētījuma nosaukums: Neironu tīklu adaptācija Atomspēku Mikroskopijas (AFM) datu analīzei dažādu vēža tipu un to stadiju klasifikācijai
| Pētījuma īstenotājs | Attiecināmās izmaksas, EUR | Publiskais finansējums, EUR |
| APPLY SIA | 181.000,00 | 112.700,00 |
Pētījuma mērķis:
Ļaundabīgie audzēji ir viena no biežākām slimībām cilvēku populācijā. Plaušu audzējs ir viens no biežākajiem audzējiem, kas raksturojas ar sliktu prognozi un augstu mirstību. Plaušu audzējs joprojām tiek atklāts vēlīnajās stadijās, kad ārstēšana ir dārga un mazefektīva.
Jauno plaušu audzēju diagnostikas risinājumu izstrāde ir aktuāla problēma mūsdienu zinātnē. Uz mākslīgā intelekta balstīta lielo datu analīze izmantojot invotatīvus datu avotus varētu būt perspektīva jauna tehnoloģija plaušu audzēju diagnostikai un prognozei ar augstu komercializācijas potenciālu.
Pētījuma mērķis ir izstrādāt jaunu tehnoloģiju, kas pamatojas uz mākslīgā intelekta analīzi, izmantojot Atomspēku Mikroskopijas (AFM) datus plaušu audzēju diagnostikai, kā arī klīnisko un patologhistoloģisku rādītāju novērtēšanu.
Pētījuma aktivitātes:
- pacientu iekļaušana pētījumā,
- klīnisko rādītāju analīze,
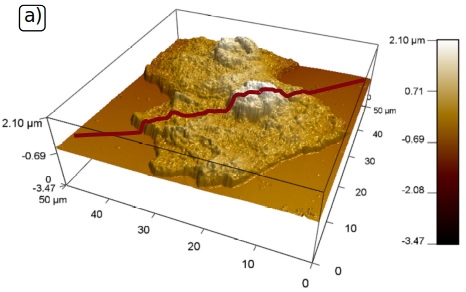
- plaušu biopsijas audu paraugu un citoloģijas audu paraugu novērtēšana ar atomspēka mikroskopiju,
- datu analīze ar mākslīgu intelektu un predikatīvo modeļu izveide.
Pētījuma īstenošanas rezultātā tiks izstrādāta metode biopsijas un citoloģijas paraugu pagatavošanai atomspēka mikroskopijai, kā arī uz mākslīgā intelekta balstīta jaunā tehnoloģija plaušu audzēja diagnostikai, kas pamatojas uz lielo datu analīzi, kas iegūti ar atomspēka mikroskopiju, un audzēja klīniskie dati.
Pētījuma rezultāti
Pētījuma galvenais mērķis bija izvērtēt, vai atomspēku mikroskopijas (AFM) tehnikā iegūto šūnu biofizikālo parametru integrācija ar klīniskiem un histopatoloģiskiem datiem var uzlabot plaušu vēža apakštipu (adenokarcinomas un plakanšūnu karcinomas) klasifikācijas precizitāti.
Analīzei tika izmantota Plaušu Vēža Fizikālo Īpašību (LCPP) datu kopa, kas ietvēra informāciju par 37 pacientiem. Biofizikālo īpašību iekļaušana mašīnmācīšanās modeļos palielināja klasifikācijas precizitāti no 86,49% līdz 89,19%. Vienlaikus Laukums Zem ROC Līknes (AUC), kas raksturo modeļa diskriminācijas spēju, statistiski nozīmīgi samazinājās no 0,903 līdz 0,847 (DeLonga tests, p-vērtība = 0,0), un būtiski pieauga modeļa sarežģītība, mērot ar Baijesa Informācijas Kritēriju (BIC).
Starp pārraudzītās mācīšanās modeļiem augstāko precizitāti (89,19%) LCPP datu kopā sasniedza vairāki algoritmi: Lēmumu koki, Atbalsta vektoru mašīnas (SVM) ar RBF un polinomiālo kodolu, Naivais Baijesa klasifikators, kā arī Baijesa tīkli ar no datiem iemācītu struktūru.
Daudzslāņu perceptrons (MLP) uzrādīja zemāku precizitāti (78,38%), savukārt nepārraudzītās mācīšanās metodes (K-vidējo, DBSCAN, hierarhiskā klasterizācija) bija neefektīvas (precizitāte 51,35%-54,05%).
Lai gan biofizikālo pazīmju tiešā ietekme uz klasifikācijas precizitāti bija ierobežota, AFM metode atklāja korelācijas starp šūnu mehāniskajām īpašībām (piemēram, elastību) un tādiem klīniskiem parametriem kā vēža stadija, diferenciācijas pakāpe un invazīvās īpašības.
Pētījuma galvenais ierobežojums bija mazais LCPP datu kopas paraugu skaits (N=37).
Baijesa tīkli ar iemācītu struktūru un rūpīgu pazīmju atlasi parādīja sevi kā daudzsološu pieeju. Nepieciešami turpmāki pētījumi ar lielākām datu kopām, lai pilnībā novērtētu AFM iegūto biofizikālo īpašību potenciālu vēža diagnostikā un klasifikācijā.
Zinātniskās publikācijas
1. Machine Learning for Lung Cancer Subtype Classification: Combining Clinical, Histopathological and Biophysical Features
Saite: https://www.mdpi.com/2075-4418/15/2/127
2. Characterization of human non-small cell lung cancer histology samples by atomic force microscopy
Saite: https://www.sciencedirect.com/science/article/abs/pii/S1549963425000450


 Projekti
Projekti











